博落回主要功能成分及其在动物生产中的应用
发布时间:
2020-06-03
来源:
摘 要:博落回[Macleaya cordata (willd.) R.Br.]又名“号筒杆”,是罂粟科博落回属的多年生草本植物。博落回富含生物碱资源,其主要功能活性成分为血根碱、白屈菜红碱、原阿片碱、别隐品碱等异喹啉类生物碱,具有抗微生物、抗炎、抗氧化、杀虫、抗病毒、抗肿瘤等多种生物学活性。文章通过对博落回主要功能成分血根碱、白屈菜红碱、原阿片碱、别隐品碱等异喹啉类生物碱的抗微生物、抗 炎、抗氧化、改善肠道健康等生物学活性及其在动物生产中的应用进行综述,以期为博落回功能成分的开发和应用提供参考。
关键词:博落回 功能成分 血根碱 白屈菜红碱 动物生产
前 言:博落回[Macleaya cordata (willd.)R.Br.]是罂粟科博落回属的多年生草本植物,全属共两种,即博落回和小果博落回[Macleaya microcarpa (Maxim) Fedde]。博落回是一种富含生物碱的传统中药材,又名“号筒杆”,在我国分布广泛,资源丰富。博落回植物中主要的生物活性物质为异喹啉类生物碱,如血根碱、白屈菜红碱、原阿片碱、别隐品碱等,具有抗微生物、杀虫、抗病毒、抗炎、抗肿瘤、改善肝脏功能、增强免疫力等多种生物学活性。2004年,以博落回植物中提取的血根碱和白屈菜红碱为主要成分的产品在欧盟注册为饲料添加剂Sangrovit[1],并在全球74个国家和地区广泛应用于动物生产,在替代饲用促生长抗生素,提高动物生长性能,改善动物健康等方面效果显著。在我国以血根碱和白屈菜红碱为主要成分的产品已经开发成国家二类新中兽药(2011 新兽药证字 34 号)和药物饲料添加剂产品博落回散(兽药添字,180415250),作为安全高效的饲用促生长抗生素替代产品广泛应用于动物生产中。本文围绕博落回主要功能成分的生物学活性及其在动物生产中的应用研究进行综述,以期为博落回功能成分的开发和应用提供参考。
1 博落回主要功能成分及其生物学活性
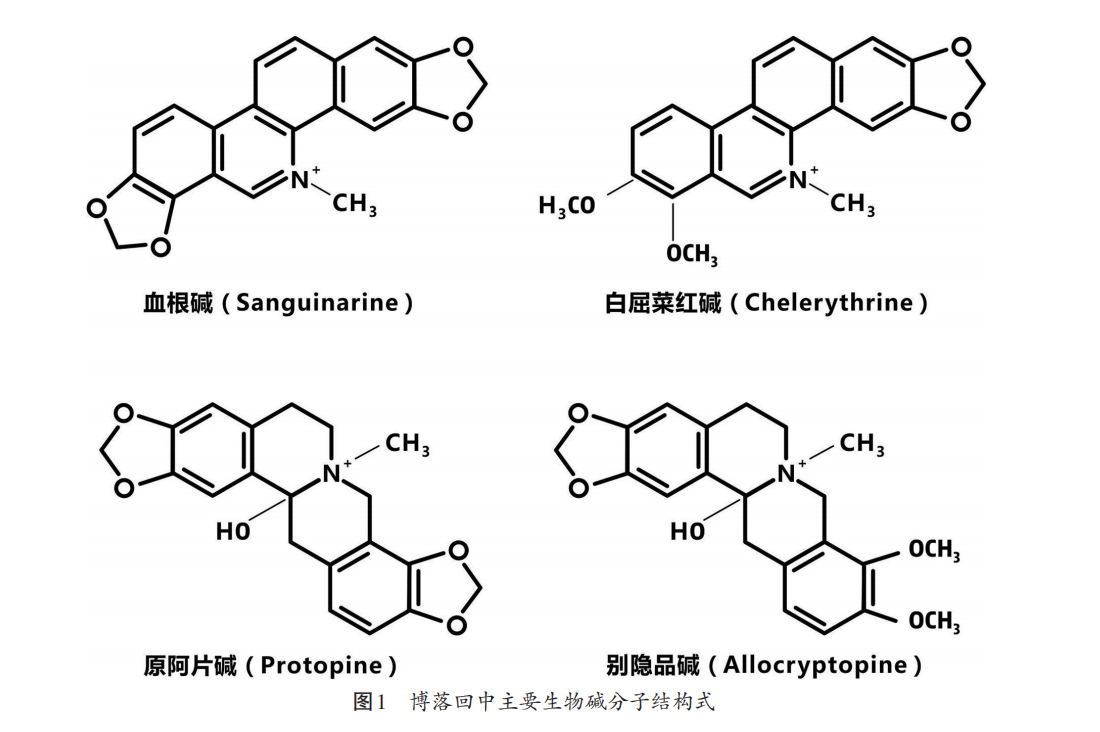
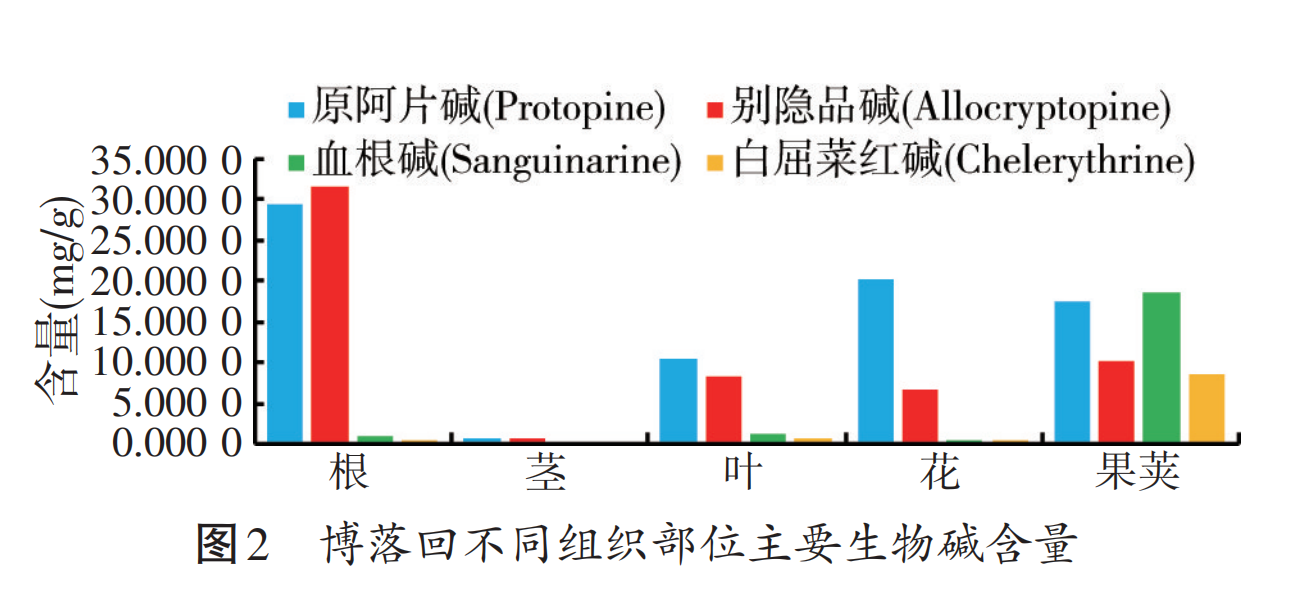
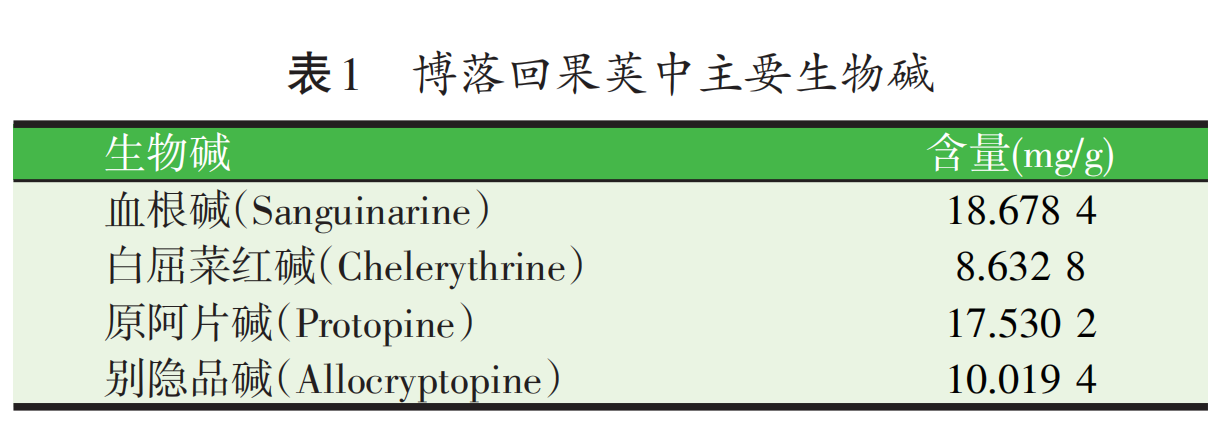
博落回中含量较高的生物碱包括血根碱、白屈菜红碱、原阿片碱和别隐品碱(见图1),它们在植物体内分布具有明显的组织特异性,果荚中生物碱含量最高,茎中含量最少;血根碱和白屈菜红碱在果荚中含量最高,原阿片碱和别隐品碱在根中含量最高(见图2),因此根和果荚为其主要的药业部位[2]。博落回果荚中血根碱、白屈菜红碱、原阿片碱、别隐品碱含量见表1,其均具有很好的抗微生物、抗炎、抗氧化、改善肠道健康及增强免疫力的生物学活性。
1.1 抗微生物活性
博落回功能成分具有很好的抗微生物活性,其中血根碱、白屈菜红碱、原阿片碱、别隐品碱等生物碱对金黄色葡萄球菌、肠球菌、大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、无乳链球菌等多种病原微生物都有较强的抑制作用[3-4]。研究表明白屈菜红碱和血根碱对革兰氏阳性菌和革兰氏阴性菌均具有一定的抗菌活性,且是PubMed和Science Direct 检索确定的10种最有效的抗菌天然生物碱中的2种[5]。从博落回植物中获取的血根碱对金黄色葡萄球菌、肠球菌的抑制作用最强,且与现有抗生素不存在交叉耐药性[3]。血根碱对沙门氏菌、金黄色葡萄球菌和大肠杆菌等具有较强抑制作用,但对枯草芽孢杆菌等益生菌的抑制作用较小,此外血根碱对病原菌的生物被膜有较强的清除作用[6],这对动物生产中滥用抗生素导致的诸多问题提供了新的解决途径。血根碱抗菌机制主要是:①通过阻止细菌中cytokinetic Z-ring 的形成,干扰FtsZ蛋白的装配,进而抑制细菌分裂[7];②通过诱导膜结合细胞壁自溶酶的释放,导致细菌的溶解[6,8]。有研究表明,血根碱和白屈菜红碱对多种真菌具有明显的抗真菌活性[9],可为安全、高效解决动物生产中霉菌毒素问题提供了参考借鉴。
1.2 抗炎活性
炎症是动物机体免疫系统对外界刺激的防御性反应。博落回功能成分具有很强的抗炎活性[10],研究证明血根碱通过抑制核转录因子-κB(nuclear factorkappa B,NF-κB)的活化,进而降低炎症因子的表达,发挥抗炎作用。NF-κB参与多个基因表达的调控,已经证实多种炎症相关疾病、肿瘤等都与 NF-κB 的活性相关[11]。NF-κB 以一种无活性状态潜伏在细胞质中表现为一种包含 p50、p65 以及 IkB-α的异源三聚体。一般情况下,NF-κB在细胞质内是静默稳定,只有当这个复合物激活时,IκB-α依次发生磷酸化,泛素化和降解,从而释放出的异源二聚体p50~p65发生核易位,进入细胞核内介导炎症相关基因表达,产生大量的炎症因子,机体炎症反应增强。血根碱能够抑制IκB-α磷酸化进而阻止NF-κB的激活,进而抑制动物炎症的表达[12]。鼠巨噬细胞体外实验表明,在脂多糖(LPS)诱导的炎症模型中,博落回提取物(主要成分为血根碱和白屈菜红碱)具有土霉素相似的抗炎活性[13]。断奶仔猪饲喂添加博落回散的日粮1周和2周后血清炎症标识物血清结合珠蛋白和淀粉样蛋白显著低于对照组[14]。
1.3 抗氧化作用
活性氧自由基(ROS)是机体代谢的产物,正常生理状态下,动物体内的ROS在机体氧化-还原反应的调控作用下维持动态平衡,但在动物遭受内外源刺激后,ROS平衡被打破,机体大量ROS聚集,诱使组织细胞出现脂质氧化、蛋白质变性、DNA损伤等,机体处于氧化应激状态,往往导致畜禽生产性能和健康水平下降,甚至出现疾病和死亡。博落回功能成分具有很强的抗氧化作用[15-16],可有效清除机体自由基,保护蛋白质氧化损伤,抑制脂质及DNA氧化损伤[17]。血根碱可以抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotin⁃amide adenime dinucleotide phosphate,NADPH)氧化酶的活性,进而减少ROS 产生,发挥抗氧化作用[18]。小鼠采食添加血根碱和白屈菜红碱的日粮后,血浆和肝脏组织中的超氧化物歧化酶、谷胱甘肽过氧化物酶浓度增加,机体氧化应激水平改善[19]。
1.4 改善肠道健康
肠道是动物营养代谢和免疫的重要器官,肠道健康水平不仅决定了动物对营养物质的消化吸收,而且对动物的生长发育和健康至关重要。肠道健康包括有效的营养物质消化吸收功能、正常的生物学屏障功能、稳定的肠道微生物菌群、健全的免疫功能等多个方面。体外试验表明,从博落回中提取的血根碱(0.012 5 μg/ml)能够促进猪肠道上皮细胞增殖[20]。大量动物试验表明,博落回中提取的血根碱和白屈菜红碱可以:①促进小肠绒毛生长,增加肠绒毛吸收面积[21];②促进肠道紧密连接蛋白表达,增强肠道黏膜屏障功能[22];③调控肠道微生物菌群,促进乳酸菌增殖,抑制大肠杆菌繁殖[21,23];④提高日粮养分消化率,促进营养物质吸收[24];⑤增加小肠黏膜免疫球蛋白水平,提高肠道黏膜免疫功能[25]。
2 博落回功能成分在动物生产中的
应用研究
博落回功能成分在动物生产中的应用研究最早可以追溯到2004年[26]。此后,国内外大量应用研究表明,以博落回功能成分血根碱、白屈菜红碱等生物碱为主要活性成分的产品,可以安全、高效地应用于动物生产,具有促进动物生长、改善动物健康、预防动物疾病等多种功能。
2.1 家禽
博落回功能成分在家禽生产中具有提高肉鸡采食量和增重,降低料肉比;改善肠道健康,提高日粮消化率,减少过料;增强机体抵抗力,预防疾病感染;提高蛋禽产蛋率,降低死淘等功效。肉鸡饲养试验表明,日粮中添加博落回提取物(主要成分为血根碱和白屈菜红碱)20g/kg 可以显著提高肉鸡的增重,降低料肉比,具有阿维菌素(10 mg/kg)相当的促生长效果;博落回提取物组肉鸡的空肠和回肠相对重量显著降低,相对长度显著增加,肠道乳酸杆菌数量显著增加[27]。在热应激环境下,博落回功能成分(血根碱、白屈菜红碱、原阿片碱、别隐品碱)可以提高肉鸡的生长性能,改善肉鸡的肠道健康[28]。Khadem等[13]研究报道在肉鸡上博落回提取物具有土霉素相似的抗炎活性和促生长效果。博落回功能成分还可以防治肉鸡沙门氏菌和产气荚膜梭菌感染,Alaeldein M. Abuda⁃bos等[29]研究报道来自博落回的苯并菲啶类生物碱能够降低鼠伤寒沙门氏菌攻毒肉鸡的肠道损伤,并促进生长性能和肠道健康的恢复。G. D. Xue等[30]研究报道从博落回中提取的生物碱能够促进产气荚膜梭菌攻毒肉鸡生长性能和产肉性能的恢复,降低攻毒肉鸡十二指肠、空肠、回肠肠道病变评分。产蛋鸡低蛋白日粮中添加血根碱可以提高蛋鸡细胞免疫和体液免疫,改善机体抗氧化水平,抑制肠道大肠杆菌和沙门氏菌增殖,改善肠道健康[31]。
2.2 猪
博落回功能成分在猪生产中的应用主要在断奶仔猪、生长猪、妊娠后期和泌乳期母猪阶段,具有促生长、抗应激、改善肠道健康等功效。早期断奶是现代集约化养猪生产的最大挑战之一,断奶后由于日粮改变、应激、环境变化等往往会造成仔猪肠道功能紊乱,甚至腹泻。在断奶仔猪日粮中添加博落回提取物(主要成分为血根碱和白屈菜红碱)可降低机体炎症水平[14],显著提高仔猪增重和饲料转换效率,并显著提高日粮中磷和氨基酸的消化率[24]。Chen J等[21]在早期断奶仔猪上的研究表明,在基础日粮中添加博落回提取物,不仅提高了仔猪的生长性能,而且改善肠道健康,其小肠绒毛高度显著增加,盲肠中乳酸菌数量显著增加,沙门氏菌及大肠杆菌数量显著降低,盲肠食糜中短链脂肪酸含量显著增加,而氨含量显著降低。在生长猪日粮中添加博落回提取物可显著提高猪的生长性能,具有与硫酸粘杆菌素类似的促生长效果,同时还可以提高血液氨基酸浓度[22],降低生长猪的腹泻评分,增强肠道屏障功能[32]。有研究表明,博落回中提取的血根碱和白屈菜红碱还可以降低运输过程猪的应激水平以及减少猪胴体沙门氏菌污染[33]。母猪妊娠后期和哺乳期日粮中添加博落回提取物可以增加活产仔数、仔猪出生重、断奶重、哺乳期成活率及哺乳期采食量,降低母猪哺乳期失重和背膘损失,缩短母猪断奶发情间隔[34]。
2.3 水产动物
博落回功能成分对血吸虫[35]、指环虫[36]、小瓜虫[37]等多种威胁水产动物生产的寄生虫具有杀灭作用,且对鲈鱼、红罗非、锦鲤、鲤鱼、南美对虾等水产动物都具有促生长、提高免疫力、改善健康等功效。鲈鱼日粮中添加50 mg/kg Sangrovit(主要成分为血根碱和白屈菜红碱)可以显著提高鲈鱼的增重和特定生长率[38]。红罗非鱼上的试验研究表明,与对照组相比,采食添加血根碱和白屈菜红碱日粮的红罗非鱼采食量、增重和特定生长率显著提高,其胴体组成、肝功能和健康状况没有明显差异[39]。Zhang R等[40]以锦鲤为试验对象,研究日粮中添加血根碱对锦鲤免疫功能、消化酶活性和肠道微生物区系的影响,结果表明日粮中添加血根碱显著降低锦鲤血液肿瘤坏死因子-α(TNF-α和丙二醛水平,显著提高血液溶菌酶、谷胱甘肽过氧化物酶、超氧化物歧化酶水平;肠道组织TNF-α和IL-1β基因的表达显著降低;肠道微生物多样性显著提高;嗜水气单胞菌攻毒后锦鲤存活率显著提高。鲤鱼上的试验表明,血根碱和白屈菜红碱可以显著提高鲤鱼的生长性能,显著降低肠道大肠杆菌数量,嗜水气单胞菌攻毒后的抵抗力明显增强[41]。博落回提取物还可以改善南美对虾机体健康度,显著降低死亡率。
2.4 反刍动物
乳房炎症不仅造成奶牛产奶性能下降,而且会降低乳品质量,博落回功能成分具有很好的抗炎活性,可以改善奶牛乳房炎,降低牛奶中的体细胞计数[42]。Estrada-Angulo A 等[43]在奶山羊上的研究表明,博落回功能成分可以提高奶山羊的抗应激能力,并促进采食量的提高。博落回功能成分可以提高反刍动物瘤胃微生物效率,减少日粮中氮的瘤胃降解,并增强后胃对氮的消化,提高氮的利用效率[44]。杂交公牛上的试验表明,与对照组相比,日粮中添加博落回功能成分可以显著提高饲料效率和胴体产量[45]。
3 总结
抗生素作为促生长剂在动物生产中的应用已有70多年的历史,其在促进动物生长、预防动物疾病、改善饲料效率方面发挥了重要作用,但也带来了细菌耐药性、环境污染、食品安全等一系列问题。在全球禁抗背景下,动物生产中迫切需要安全、高效的替代产品,中兽药和天然植物提取物具有天然、多功能、低毒副作用、安全性高、无耐药等特点,是动物生产中抗生素的理想替代品。博落回功能成分血根碱、白屈菜红碱、原阿片碱、别隐品碱等具有广泛的抗微生物、抗 炎、抗氧化、改善肠道健康等生物学活性,以血根碱和白屈菜红碱为主要成分的产品已经开发注册成国家二类新中兽药和药物饲料添加剂,广泛应用于促进动物生长、改善动物健康及抗生素替代。笔者根据博落回替抗产品开发经验总结了“整肠、抗炎、促生长”的饲用抗生素替代技术,即通过调控肠道微生物,维护肠道完整性,降低肠道炎症,最终达到促进动物生长的目的。因此,具有调控肠道菌群和抗炎活性的植物提取物(天然产物)是未来饲用抗生素产品研发的一个重要方向。
参考文献
[1] European Commission. European Union Register of Feed Addi⁃tives Pursuant to Regulation (EC) No 1831/2003[Z]. 03.23.2017.
[2] 刘秀斌. 基于同位素标记L-酪氨酸研究博落回中血根碱生源合成途径[D].湖南农业大学,2017.
[3] 苏红,白华,骆延波, 等. Sangrovit对临床多抗菌株的抑制作用及对肉鸡生长促进的饲养试验[J].饲料工业,2012,33(7):27-33.
[4] Kosina P, Gregorova J, Gruz J, et al. Phytochemical and antimicro⁃bial characterization of Macleayacordata herb[J].Fitoterapia,2010, 81(8): 1006-1012.
[5] Cushnie T P T, Cushnie B, Lamb A J. Alkaloids: an overview of their antibacterial, antibiotic- enhancing and antivirulence activi⁃ties[J]. International Journal of Antimicrobial Agents, 2014, 44(5):377-386.
[6] 王静慧,韩剑众,曲道峰.血根碱体外抑菌作用及其对细菌生物被膜的影响[J].中国畜牧杂志 ,2012(19):67-70.
[7] Beuria T K, Santra M K, Panda D. Sanguinarine blocks cytokine⁃sis in bacteria by inhibiting FtsZ assembly and bundling[J]. Bio⁃chemistry, 2005, 44(50): 16584-16593.
[8] Obiang-Obounou B W, Kang O H, Choi J G, et al. The mecha⁃nism of action of sanguinarine against methicillin-resistant Staphy⁃lococcus aureus[J]. The Journal of toxicological sciences, 2011, 36(3): 277-283.
[9] Yang X J, Miao F, Yao Y, et al. In vitro antifungal activity of san⁃guinarine and chelerythrine derivatives against phytopathogenicfungi[J]. Molecules, 2012, 17(11): 13026-13035.
[10] Lenfeld J, Kroutil M, Maršálek E, et al. Antiinflammatory activi⁃ty of quaternary benzophenanthridine alkaloids from Cheli⁃donoum majus[J]. Planta medica, 1981, 43(10): 161-165.
[11] Baldwin Jr A S. The NF-κB and IκB proteins: new discoveries and insights[J]. Annual review of immunology, 1996, 14(1): 649-681.
[12] Chaturvedi M M, Kumar A, Darnay B G, et al. Sanguinarine (pseudochelerythrine) is a potent inhibitor of NF- κB activation,IκBα phosphorylation, and degradation[J]. Journal of Biological Chemistry, 1997, 272(48): 30129-30134.
[13] Khadem A, Soler L, Everaert N, et al. Growth promotion in broil⁃ers by both oxytetracycline and Macleaya cordata extract is based on their anti-inflammatory properties[J]. British journal of nutrition, 2014, 112(7): 1110-1118.
[14] Kantas D, Papatsiros V G, Tassis P D, et al. The effect of a natu⁃ral feed additive (Macleaya cordata), containing sanguinarine, onthe performance and health status of weaning pigs[J]. Animal Sci⁃ence Journal, 2015, 86(1): 92-98.
[15] Zhong M, Huang K, Zeng J, et al. Determination of contents of eight alkaloids in fruits of Macleaya cordata (Willd) R. Br. from different habitats and antioxidant activities of extracts[J]. Journal of Central South University of Technology, 2010, 17(3): 472-479.
[16] Li C M, Yang X Y, Zhong Y R, et al. Chemical composition, an⁃tioxidant and antimicrobial activity of the essential oil from the leaves of Macleaya cordata (Willd) R. Br[J]. Natural product re⁃search, 2016, 30(4): 438-442.
[17] 姚雯,杨天衡,刘学波.血根碱清除自由基及抑制生物大分子氧化的作用[J].食品科学,2014,35(9):137-141.
[18] Vrba J, Hrbáč J, Ulrichová J, et al. Sanguinarine is a potent in⁃hibitor of oxidative burst in DMSO- differentiated HL- 60 cells by a non- redox mechanism[J]. Chemico- biological interactions,2004, 147(1): 35-47.
[19] Zdarilova A, Vrublova E, Vostalova J, et al. Natural feed addi⁃tive of Macleaya cordata: safety assessment in rats a 90- day feeding experiment[J]. Food and Chemical Toxicology, 2008, 46(12): 3721-3726.
[20] 李杰,伍树松,熊兴耀, 等.博落回生物碱对猪肠上皮细胞增殖的影响[J].动物营养学报,2014(6):1632-1637.
[21] Chen J, Kang B, Zhao Y, et al. Effects of natural dietary supple⁃mentation with Macleayacordata extract containing sanguinarine on growth performance and gut health of early-weaned piglets[J].Journal of animal physiology and animal nutrition, 2018, 102(6):1666-1674.
[22] Liu G, Guan G, Fang J, et al. Macleaya cordata extract de⁃creased diarrhea score and enhanced intestinal barrier function in growing piglets[J]. BioMed research international, 2016: 1-7.
[23] Huang P, Zhang Y, Xiao K, et al. The chicken gut metagenome and the modulatory effects of plant- derived benzylisoquinoline alkaloids[J]. Microbiome, 2018, 6(1): 211.
[24] Goodarzi Boroojeni F, Männer K, Zentek J. The impacts of Ma⁃cleaya cordata extract and naringin inclusion in post- weaningpiglet diets on performance, nutrient digestibility and intestinal histomorphology[J]. Archives of animal nutrition, 2018, 72(3):178-189.
[25] 陈家顺,康宝聚,曾建国, 等.血根碱对断奶仔猪生长性能、肠道形态结构及小肠黏膜免疫功能的影响[J].动物营养学报,2018,30(5):1845-1853.
[26] Kosina P, Walterova D, Ulrichová J, et al. Sanguinarine and chel⁃erythrine: assessment of safety on pigs in ninety days feeding ex⁃periment[J]. Food and Chemical Toxicology, 2004, 42(1): 85-91.
[27] Lee K W, Kim J S, Oh S T, et al. Effects of dietary sanguinarine on growth performance, relative organ weight, cecal microflora,serum cholesterol level and meat quality in broiler chickens[J].The Journal of Poultry Science, 2015, 52(1): 15-22.
[28] Reansoi A, Ruangpanit Y, Attamangkune S. Effect of quaternary benzophenantridine and protopine alkaloids on growth response and gut health of broiler under hot climate management[C].Annu⁃al Conference Kasetsart, Bankok, Thailand, 2015:36-41.
[29] Abudabos A M, Hussein E O S, Ali M H, et al. The effect of some natural alternative to antibiotics on growth and changes inintestinal histology in broiler exposed to Salmonella challenge[J].Poultry science, 2019, 98(3): 1441-1446.
[30] Xue G D, Wu S B, Choct M, et al. Impact of a Macleaya corda⁃ta- derived alkaloid extract on necrotic enteritis in broilers[J].Poultry science, 2017, 96(10): 3581-3585.
[31] Bavarsadi M, Mahdavi A H, Ansari-Mahyari S, et al. Effects ofdifferent levels of sanguinarine on antioxidant indices, immuno⁃logical responses, ileal microbial counts and jejunal morphology of laying hens fed diets with different levels of crude protein[J].Journal of animal physiology and animal nutrition, 2017, 101(5):936-948.
[32] Liu G, Aguilar Y M, Zhang L, et al. Dietary supplementation with sanguinarine enhances serum metabolites and antibodies in growing pigs[J]. Journal of Animal Science, 2016, 94(3): 75-78.
[33] Artuso-Ponte V, Moeller S, Rajala-Schultz P, et al. Supplementa⁃tion with quaternary benzo (c) phenanthridine alkaloids de⁃creased salivary cortisol and Salmonella shedding in pigs after transportation to the slaughterhouse[J]. Foodborne pathogens and disease, 2015, 12(11): 891-897.
[34] Matulka R A, Dohms J. Effects of the Consumption of Macleaya⁃cordata Extract Preparation by Sows[J]. Open Journal of Animal Sciences, 2018, 8(3): 294.
[35] Moraes De J. Natural products with antischistosomal activity[J].Future medicinal chemistry, 2015, 7(6): 801-820.
[36] 芦程.血根碱杀灭指环虫机制及对金鱼免疫毒理研究[D].西北农林科技大学,2013
[37] 姚嘉赟,沈锦玉.博落回杀灭小瓜虫活性成分的研究[C].2010年中国水产学会学术年会论文摘要集.中国西安,中国水产学会,2011:252-252.
[38] Ali Y Korkut, Aysun Kop. Effect of Sangrovit® on the growth and performance of sea bass[J]. The Iinternational Magazine for the Aquaculture Feed Industry, 2012, 6(6): 28-29.
[39] Rawling M D, Merrifield D L, Davies S J. Preliminary assess⁃ment of dietary supplementation of Sangrovit® on red tilapia(Oreochromis niloticus) growth performance and health[J]. Aqua⁃culture, 2009, 294(1/2): 118-122.
[40] Zhang R, Wang X W, Zhu J Y, et al. Dietary sanguinarine affect⁃ed immune response, digestive enzyme activity and intestinal mi⁃crobiota of Koi carp (cryprinus carpiod) [J]. Aquaculture, 2019,502: 72-79.
[41] Imanpoor M R, Roohi Z. Effects of Sangrovit-supplemented diet on growth performance, blood biochemical parameters, survival and stress resistance to salinity in the C aspian roach (R utilus⁃rutilus) fry[J]. Aquaculture research, 2016, 47(9): 2874-2880.
[42] Wang W, Dolan L C, Von Alvensleben S, et al. Safety of stan⁃dardized Macleayacordata extract in an eighty-four- day dietary study in dairy cows[J]. Journal of animal physiology and animal nutrition, 2018, 102(1): 61-68.
[43] Estrada-Angulo A, Aguilar-Hernández A, Osuna-Pérez M, et al.Influence of quaternary benzophenantridine and protopine alka⁃loids on growth performance, dietary energy, carcass traits, vis⁃ceral mass, and rumen health in finishing ewes under conditionsof severe temperature-humidity index[J]. Asian-Australasian jour⁃
nal of animal sciences, 2016, 29(5): 652.
[44] Aguilar-Hernández J A, Urías-Estrada J D, López-Soto M A, et al. Evaluation of isoquinolinealkaloid supplementation levels on ruminal fermentation, characteristics of digestion, and microbial protein synthesis in steers fed a high- energy diet[J]. Journal of Animal Science, 2016, 94(1): 267-274.
[45] Michels A, Neumann M, Leão G F M, et al. Isoquinoline alka⁃loids supplementation on performance and carcass traits of feed⁃lot bulls[J]. Asian-Australasian journal of animal sciences, 2018,31(9): 1474.
博落回,血根碱,白屈菜红碱,号筒杆,博落回散,博落回提取物,中兽药,原阿片碱,别隐品碱
下一页
下一页
最新新闻
2024-04-18
2022-06-14
2019-02-19
2022-11-01
2020-07-15
2024-04-09

微信公众号

官方视频号

官方抖音号

官方快手号

